INFORMACION SOBRE LA PROPIEDAD INTELECTUAL: OMS-OMPI-OMC
Chapter I: Tecnologías médicas: principios fundamentales
D. Factores que configuran las políticas de salud pública
Puntos destacados |
|
|
|
|
|
1. Cómo conseguir resultados eficaces en un entorno normativo complejo
Responder de manera sostenible a la demanda mundial tanto de innovaciones en materia de tecnologías médicas como de un acceso eficaz y equitativo a las tecnologías que se necesitan es una tarea compleja y en constante evolución. Aunque se suele expresar en términos abstractos o políticos, la finalidad fundamental de la tarea es la mejora de los resultados sanitarios. La creación de tecnologías médicas nuevas, su evaluación, y la atención a su distribución eficaz procurando que se usen de forma racional son, en definitiva, procesos prácticos que engloban desde los trabajos de investigación científica en laboratorios hasta los cuidados que proporciona el personal de enfermería en consultorios sobre el terreno.
El entorno normativo, económico y jurídico influye y puede resultar determinante en las medidas aplicadas, las elecciones realizadas, las prioridades establecidas y los recursos asignados en la práctica. El entorno normativo abarca un complejo entramado de instrumentos jurídicos, normativos y de políticas en los ámbitos nacional, regional e internacional que atañen a diversas esferas, como la salud pública, el comercio internacional y el régimen de propiedad intelectual. No se puede progresar eficazmente y mantener, de forma continuada, el efecto en la salud pública si se trabaja únicamente en el ámbito de un conjunto particular de políticas o instrumentos jurídicos. La falta de coherencia entre la legislación y las políticas en distintos campos, o la posibilidad de que entren en conflicto, puede obstaculizar ese progreso y menoscabar los beneficios prácticos. Por consiguiente, la coordinación armoniosa entre estas distintas medidas normativas en beneficio de la salud pública en general exige conocer los puntos de contacto entre ellas.
2. La transformación de las intersecciones entre políticas: de límites a sinergias
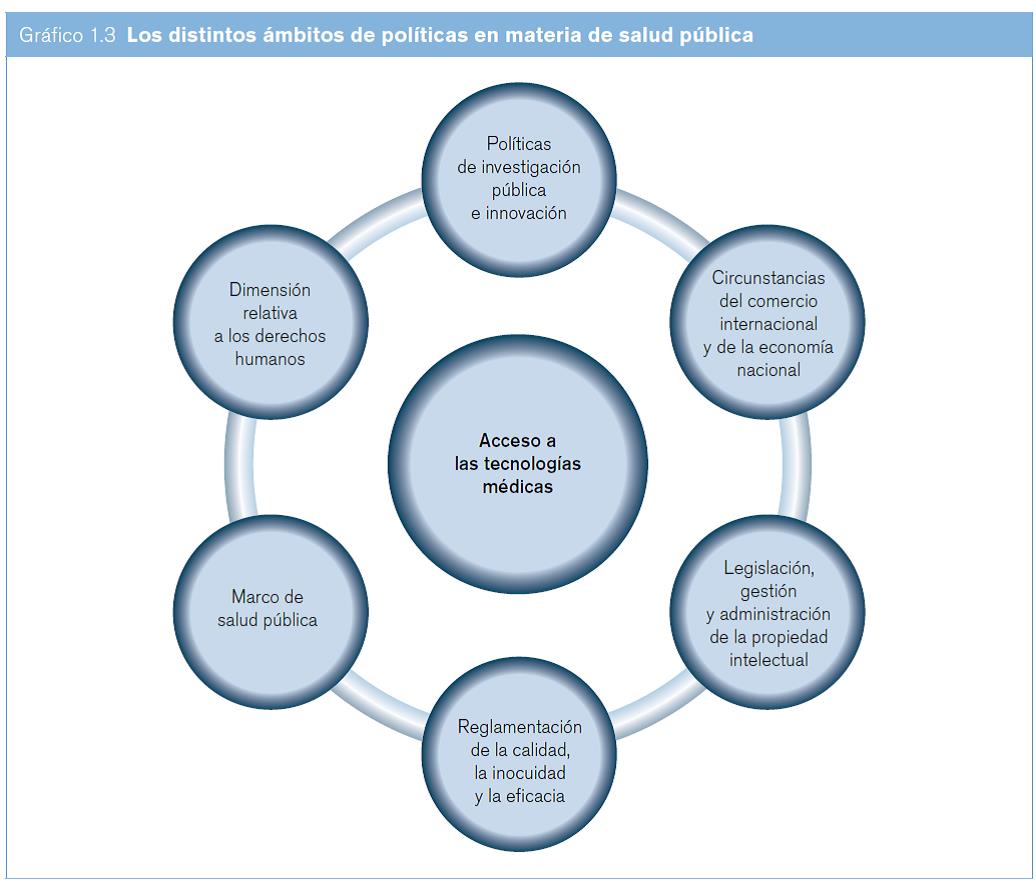
En el reciente debate sobre políticas de salud pública se ha puesto énfasis reiteradamente en los puntos de contacto (o "intersecciones"), es decir en conocer los vínculos e interrelaciones entre ámbitos jurídicos y normativos diferentes (véase el gráfico 1.3). En el presente estudio se distinguen dos niveles de confluencia:
- Las interacciones entre los principios relativos a las leyes y a las políticas en distintos ámbitos que determinan la interpretación y aplicación práctica de los instrumentos jurídicos y normativos para promover la salud pública.
- La integración de conjuntos de datos obtenidos de diversos campos, para que los responsables de la formulación de políticas puedan contar con una base de información mejorada en la que se integren datos relativos a la salud pública, los factores determinantes del acceso a las tecnologías médicas, el alcance de los derechos de propiedad intelectual pertinentes y el marco relativo al comercio.
La noción de "sinergia" puede ilustrar cómo esas intersecciones pueden pasar de ser límites formales entre los distintos ámbitos de políticas a convertirse en puntos de apoyo y beneficio mutuo. La sinergia es la interacción de diversos elementos para lograr resultados que no se podrían obtener a través de acciones independientes. El acceso a los medicamentos es un claro ejemplo de aplicación de la sinergia. De hecho, la relación sinérgica entre la salud, el comercio y la propiedad intelectual constituye, tal vez, la principal enseñanza práctica que cabe extraer del debate de estos últimos 10 años sobre la propiedad intelectual y el acceso a los medicamentos.
En ocasiones se considera que el comercio y las perspectivas comerciales chocan sustancialmente con la promoción de la salud pública. Sin embargo, el entorno comercial, la promoción de la competencia y de la innovación en el sector privado y la reglamentación del comercio son factores determinantes del acceso a los medicamentos. El comercio internacional es decisivo a efectos del acceso a las tecnologías médicas, y aunque algunos países aspiran a impulsar la producción local, ninguno puede aspirar a ser totalmente autosuficiente. Teniendo en cuenta que el acceso depende de la asequibilidad, las economías de escala en la industria y un mercado más competitivo generan oportunidades para mejorar los resultados sanitarios. Por lo general, la apertura al comercio internacional promueve la competencia y favorece la asequibilidad y el acceso. Permitir que aumente el número de proveedores que atiende a la población también puede potenciar la seguridad del suministro. El marco de las políticas comerciales, por ejemplo, en materia de aranceles, contingentes y otras reglamentaciones, repercute directamente en los precios y la disponibilidad de los medicamentos. Muchos gobiernos han adoptado medidas jurídicas y normativas nacionales para permitir o promover la competencia de los medicamentos genéricos en el suministro de medicamentos y contribuir así a reducir los precios. Las normas de la OMC se han interpretado en el marco de la solución de diferencias para dar cabida a objetivos de salud pública como, por ejemplo, la potenciación de la entrada de medicamentos genéricos; y en la Declaración de Doha se ha establecido que el Acuerdo sobre los ADPIC se puede interpretar desde el punto de vista de la salud pública.
Las políticas comerciales y los aspectos económicos de los sistemas mundiales de producción también son factores clave en los planes estratégicos para fortalecer la capacidad de producción nacional que tienen como objeto mejorar el acceso a los productos médicos. En un entorno fiscal en el que los presupuestos nacionales atraviesan dificultades y los programas filantrópicos se enfrentan a reducciones de financiación, las políticas de adquisición que favorecen procedimientos de licitación abiertos y competitivos, unidas a la utilización racional de los medicamentos, cobran aún más importancia a la hora de proteger la continuidad del acceso. También, los programas de acceso a los medicamentos se beneficiarán de un uso mejor y más integrado de la información, en particular de los datos sobre la carga de morbilidad actual y prevista, la eficacia de los medicamentos, los precios de los medicamentos y su situación a efectos de la propiedad intelectual, y las medidas comerciales y reglamentarias.
Durante el pasado decenio, el acceso a los medicamentos se ha situado en el centro de un debate transversal sobre políticas relativas a diferentes ámbitos. Los responsables de la formulación de políticas han elaborado progresivamente el marco de políticas relativas al acceso, por medio de diversos instrumentos como la Declaración de Doha, resoluciones de la Asamblea Mundial de la Salud e instrumentos de defensa de los derechos humanos. Más recientemente, los debates sobre políticas también han centrado su atención en el ámbito de la innovación; de hecho, la interfaz entre la innovación y el acceso es un aspecto fundamental y piedra angular del presente estudio.
En la formulación de políticas orientadas a promover el acceso o la innovación se ha de tener en cuenta que ambos conceptos están inextricablemente ligados. No basta con limitarse a potenciar y mejorar el acceso a los medicamentos ya existentes y cuya eficacia se ha comprobado, sino que es preciso ampliar constantemente la farmacopea actual para adecuarla a la evolución de la carga de morbilidad. Por ejemplo, los responsables de la formulación de políticas han centrado recientemente su atención en el progresivo aumento de la carga de las enfermedades no transmisibles en el mundo en desarrollo. La aparición de nuevas cepas víricas y el problema de la resistencia de las bacterias a los antibióticos actuales limitan la eficacia de los tratamientos existentes. Además, históricamente, la innovación en medicina no se ha ocupado de las principales enfermedades endémicas en el mundo en desarrollo.
Las necesidades y los requisitos cambian constantemente -debido en parte a la continua evolución de la carga de morbilidad-, de modo que las demandas de distintos tipos de tecnologías, tanto nuevas como adaptadas, están sujetas a una constante transformación. Por consiguiente, la interacción entre el acceso y la innovación se puede considerar, de forma integrada, como un bucle de retroinformación positiva entre la carga de morbilidad y la respuesta en términos de innovación en el que se vinculan tres aspectos: la determinación de las necesidades del sector de la salud; el desarrollo de tecnologías innovadoras y la adaptación de las existentes para satisfacer esas necesidades; y la aplicación, difusión y distribución de tecnologías eficaces y seguras, de calidad comprobada. La innovación puede tener como objetivo específico mejorar el acceso; por ejemplo, para utilizar ciertas tecnologías de diagnóstico puede ser necesario contar con personal calificado o infraestructuras especializados, pero muchos pacientes pueden carecer de acceso a estos recursos. En entornos con pocos recursos, para mejorar el acceso de las comunidades a estas tecnologías podría ser necesario crear versiones nuevas que puedan manejarse sin contar con esa ayuda o infraestructura.
3. Fortalecimiento de los vínculos entre los ámbitos local, nacional y mundial
La promoción de las políticas de innovación en medicina plantea una situación particularmente difícil, puesto que se sitúa en la confluencia de varios ámbitos. El imperativo de la innovación en la esfera de las tecnologías médicas puede resumirse en los dos componentes siguientes:
- en primer lugar, obtener los recursos necesarios (cabe destacar los conocimientos técnicos, la capacidad de investigación y de desarrollo de productos, la experiencia especializada en ensayos clínicos, la infraestructura de reglamentación, las tecnologías de base y generalistas o "de plataforma" y las herramientas de investigación, y la inversión de capital público y privado);
- en segundo lugar, aplicar estos recursos de la forma más eficaz para satisfacer las necesidades de salud pública insatisfechas.
Sin embargo, para lograr lo anterior es necesario trabajar en un terreno en el que se entrecruzan de forma compleja varios ámbitos de políticas; aplicar una combinación de incentivos e intervenciones en el mercado, financiación y otras ayudas a la investigación y el desarrollo; construir infraestructuras; y crear una base de investigación pública y formar personal investigador calificado. De modo parecido, la promoción de la innovación puede conllevar una mejor utilización de los recursos disponibles, la potenciación del acceso a las tecnologías existentes, la utilización de los conocimientos sobre desarrollo de medicamentos y la infraestructura de investigación y desarrollo, y un mayor aprovechamiento de la capacidad de innovación e investigación autóctona, con el fin de ampliar el conjunto de tecnologías médicas en desarrollo. Múltiples instrumentos jurídicos y normativos -en los ámbitos internacional, regional y nacional- influyen en la actividad innovadora.
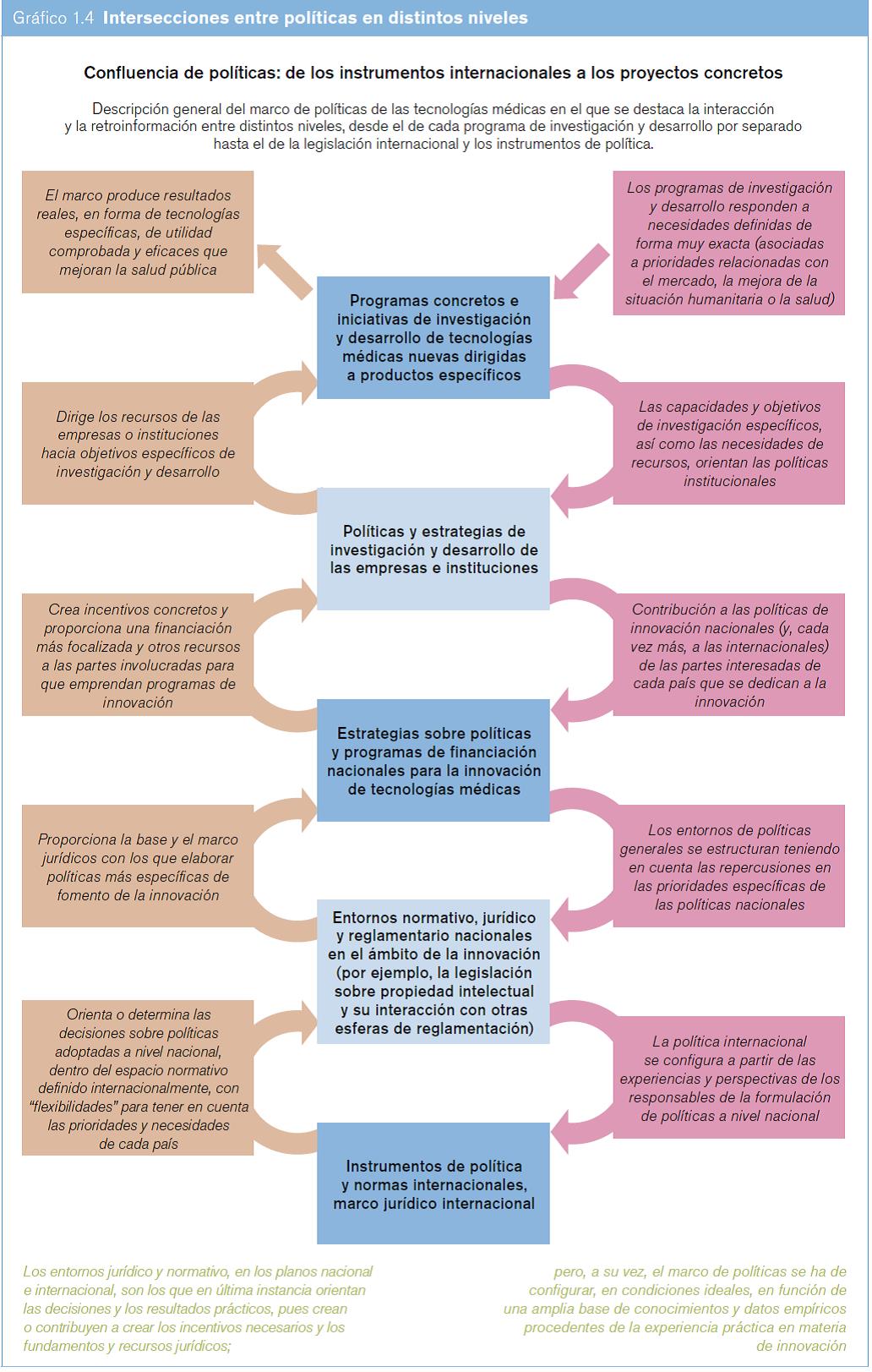
Los instrumentos jurídicos internacionales se deben considerar desde la perspectiva de la experiencia de su aplicación en cada país. Por consiguiente, para poder comprender de forma sistemática los puntos de contacto entre estos distintos estratos de políticas y prácticas hay que conocer en profundidad cómo se influyen recíprocamente (véase la columna central del gráfico 1.4). De ese modo se podrá evaluar la forma en que las políticas internacionales, nacionales e institucionales determinan los resultados reales de la innovación y, a su vez, qué influencia tiene la experiencia práctica en el marco de las políticas.
4. El criterio empírico como base para la formulación de políticas
Actualmente, los responsables de la formulación de políticas que se enfrentan a las dificultades que plantean la innovación y el acceso a las tecnologías médicas son más numerosos y diversos que nunca, y tienen que lidiar con múltiples estructuras normativas, jurídicas y administrativas a los niveles nacional, regional e internacional. Por ejemplo, las autoridades de reglamentación nacionales que tratan de proteger a la población frente a los medicamentos inseguros o ineficaces manejan datos de ensayos clínicos que pueden están amparados por leyes de propiedad intelectual, y trabajan en un marco jurídico y normativo condicionado por múltiples instrumentos internacionales y regionales. Las oficinas de patentes, que se enfrentan a una carga de trabajo sin precedentes, deben emplear las mejores fuentes de datos tecnológicos posibles para buscar y examinar información sobre el estado de la técnica1, con el fin de decidir si conceder o no patentes a las invenciones reivindicadas. Los programas de adquisición tienen que enfrentarse a numerosos factores que evolucionan con rapidez, al mismo tiempo que evalúan los cambios de la carga de morbilidad y las necesidades médicas, la selección de tecnologías médicas esenciales, la eficacia, los precios y la disponibilidad, así como aspectos relativos a la reglamentación y la propiedad intelectual. Todos estos factores diversos tienen en común la necesidad de una base empírica más sólida para que las políticas seleccionadas tengan más posibilidades de satisfacer las necesidades prácticas. Afortunadamente, en el último decenio se han producido mejoras significativas en la calidad y exhaustividad de los datos, así como en el acceso a los instrumentos informáticos necesarios para convertir los datos primarios en servicios de información accesibles para las partes interesadas.
Recuadro 1.2. Conceptos fundamentales sobre las tecnologías sanitarias y médicas |
Aunque las expresiones "tecnologías sanitarias" y "tecnologías médicas" se emplean a veces de forma intercambiable, la primera es más amplia y engloba a la segunda. Ninguna de las dos se ha definido de forma estricta. La OMS define las tecnologías sanitarias como la aplicación de conocimientos teóricos y prácticos estructurados en forma de dispositivos, medicamentos, vacunas, procedimientos y sistemas elaborados para resolver problemas sanitarios y mejorar la calidad de vida.2 |
Las tecnologías sanitarias comprenden, por ejemplo, las ayudas técnicas, como los bastones que utilizan los invidentes, o las cintas sin fin y otros equipos para hacer ejercicio que se utilizan para mejorar la salud de una persona. Las tecnologías médicas, por su parte, se asocian al concepto de intervención médica, que puede ser preventiva (por ejemplo, vacunas), de diagnóstico (por ejemplo, estuches de diagnóstico in vitro, estetoscopios o termómetros), de tratamiento (por ejemplo, medicamentos, instrumental quirúrgico, técnicas quirúrgicas e implantes), de rehabilitación (por ejemplo, equipos de fisioterapia o ayudas técnicas, como las muletas). Los dispositivos médicos son un subgrupo de tecnologías médicas, e incluyen todo instrumento, aparato, utensilio, máquina, implante, reactivo o calibrador in vitro, software, material o producto similar o relacionado que no logra el efecto principal perseguido en o sobre el organismo humano únicamente por medios farmacológicos, inmunológicos o metabólicos, como pueden ser las jeringas, los desfibriladores, las pruebas in vitro o las prótesis de cadera. |
A medida que las tecnologías evolucionan, aparecen más productos combinados, sobre todo en el ámbito de los equipos de administración de medicamentos. También hay cada vez más ejemplos de tecnologías médicas combinadas; un ejemplo son los inhaladores para el tratamiento del asma, dispositivos para la administración de una dosis establecida de un medicamento en forma de aerosol. |
Indudablemente, la tecnología es un componente fundamental de la salud pública (véase el recuadro 1.2); los medicamentos, desde los antibióticos a los antirretrovíricos, han sido fundamentales para lograr mejoras drásticas en materia de salud pública; las vacunas han eliminado casi por completo la amenaza de ciertas enfermedades; y otras tecnologías, como el diagnóstico por imagen, han transformado el diagnóstico y el tratamiento. Estas tecnologías no se han generado de forma espontánea, sino que son fruto de extensas actividades de investigación y desarrollo. El desarrollo de estas tecnologías ha sido un proceso complejo, a menudo arriesgado e incierto, basado en aportaciones de fuentes muy diversas, tanto del sector público como del privado, y que con frecuencia han requerido minuciosas comprobaciones y la supervisión de las autoridades de reglamentación. La innovación farmacológica es una de las formas de desarrollo tecnológico más caras e inciertas, y requiere de estructuras de innovación específicas, una estrecha vigilancia en materia de reglamentación y sobre cuestiones éticas, normas sobre seguridad y eficacia suficientemente rigurosas, e incentivos específicos u orientados.
Cuadro 1.2. Definición, finalidad y naturaleza física de las tecnologías médicas |
Finalidades o aplicación (con ejemplos) de las tecnologías sanitarias
|
Prevención: vacunas, dispositivos anticonceptivos, inmunización, programa de control de infecciones hospitalarias, abastecimiento de agua fluorada, sal yodada. |
Pruebas de tamizaje: citología cervicovaginal (prueba Papanicolaou), prueba de la tuberculina, mamografía, análisis de la concentración sérica de colesterol. |
Diagnóstico: estetoscopio o fonendoscopio, diagnóstico in vitro, electrocardiograma, prueba serológica para el diagnóstico de fiebre tifoidea, estudios radiográficos. |
Tratamiento: medicamentos antivíricos, hemodiálisis, injerto de revascularización coronaria, psicoterapia, analgésicos, antibióticos. |
Rehabilitación: programa de ejercicios para pacientes que han sufrido un accidente cerebrovascular, ayudas técnicas para personas con deficiencias del habla graves, artículos para la incontinencia, audífonos. |
Naturaleza física de las tecnologías sanitarias o médicas. |
Medicamentos: sustancias sintéticas destinadas al diagnóstico, el tratamiento o la prevención de enfermedades; por ejemplo: ácido acetilsalicílico, bloqueantes ß, antibióticos, antidepresivos. |
Productos biológicos: sustancias terapéuticas derivadas del organismo humano o de los animales, y productos de la biotecnología. Ejemplos: vacunas, hemoderivados, citoterapia y genoterapia. |
Dispositivos médicos: todo instrumento, aparato, utensilio, máquina, implante, reactivo o calibrador in vitro, software, material o producto similar o relacionado que no logra el efecto principal perseguido en o sobre el organismo humano únicamente por medios farmacológicos, inmunológicos o metabólicos;3 por ejemplo: jeringas, desfibriladores, pruebas de detección in vitro del VIH, instrumental quirúrgico, prótesis de cadera, aceleradores lineales. |
Técnicas médicas y quirúrgicas: psicoterapia, asesoramiento sobre nutrición, coronariografía, colecistectomía. |
Sistemas de apoyo: expediente clínico electrónico, sistemas de telemedicina, listas de medicamentos, bancos de sangre, laboratorios clínicos.
|
Sistemas de organización y gestión: sistemas de pago anticipado basados en grupos relacionados por el diagnóstico, modelos alternativos de atención médica, protocolos asistenciales, programas de gestión integral de la calidad.
|
Fuente: National Information Center on Health Services Research and Health Care Technology (NICHSR, Centro estadounidense de información sobre investigación en servicios de salud y tecnología para la atención de salud), HTA101: II. Fundamental Concepts, disponible (en inglés) en: www.nlm.nih.gov/nichsr/hta101/ta10104.html
En el cuadro 1.2 se proporcionan ejemplos de tecnologías sanitarias y médicas clasificadas en función de su finalidad y naturaleza física. Proporcionar acceso a las tecnologías médicas esenciales, el meollo del presente estudio, es un componente fundamental de una respuesta eficaz, pero no es en absoluto suficiente. A nivel nacional, se requiere el compromiso político por parte de los gobiernos para asignar al sector sanitario los recursos económicos necesarios para desarrollar sistemas de salud sólidos. La prevención es otro aspecto clave; por ejemplo, una proporción importante de la carga de morbilidad por enfermedades no transmisibles se puede prevenir reduciendo la exposición de la población al consumo de tabaco, a dietas malsanas, a la inactividad física y al consumo nocivo de alcohol. En este sentido, se requieren programas eficaces de prevención de enfermedades y promoción de la salud que aborden los principales factores de riesgo. Un medicamento mejorado puede resultar dañino si se prescribe de forma incorrecta o se administra de forma indebida. La tecnología médica avanzada de diagnóstico por imagen es inútil si no se cuenta con especialistas en diagnóstico debidamente capacitados y la infraestructura necesaria. Por consiguiente, el acceso efectivo a las tecnologías médicas puede depender del acceso a la infraestructura y los servicios pertinentes, tanto clínicos como técnicos.
La transformación y evolución de la carga de morbilidad genera una necesidad continua de desarrollar medicamentos nuevos y de adaptar los existentes para que sean más eficaces. El acceso a las tecnologías médicas necesarias no es, por tanto, una ecuación inmutable, sino que las estrategias de acceso adecuadas deben tener como característica fundamental el reconocimiento del valor de la innovación orientada y apropiada, tanto para generar avances decisivos como para adaptar y mejorar las tecnologías existentes.
La innovación no tiene lugar al margen de las preocupaciones sobre el acceso equitativo a los medicamentos y a otras tecnologías médicas. Obviamente, el valor social de las innovaciones médicas se debe medir en parte en función de su grado de disponibilidad efectiva y sostenible para las personas que la necesitan. No se puede conseguir que las nuevas tecnologías tengan una repercusión generalizada y equitativa en la salud si no se logra antes que existan medios de acceso adecuados a los productos terminados. Por tanto, en toda política general sobre innovaciones médicas se debe tener en cuenta también la dimensión del acceso -es decir, el modo en que una nueva tecnología se va a poner a disposición, en la práctica, de quienes la necesitan-, para que no se limite a ser una teoría abstracta ni quede reservada a un grupo reducido de la sociedad. La integración de las consideraciones relativas al acceso en las políticas sobre innovación abarca numerosas dimensiones, desde el objetivo principal de las actividades de investigación y desarrollo de productos a las actividades de desarrollo de versiones de tecnologías existentes "apropiadas" o adaptadas a entornos clínicos con pocos recursos, así como la consideración de estrategias y mecanismos relativos a la libertad para operar a fin de integrar las tecnologías en un producto terminado, de manera que se pueda distribuir extensamente y de la forma más eficaz.
El acceso también debe entenderse en un contexto más amplio; por ejemplo, la reglamentación de los productos médicos es una parte integral de la ecuación del acceso, el cual no se limita a la capacidad de compra o el suministro de un producto básico o de consumo. La disponibilidad de una tecnología debe estar respaldada generalmente por una reglamentación sólida y mecanismos de vigilancia y observancia para ofrecer garantías razonables de que la tecnología sea segura y eficaz. De manera parecida, muchos medicamentos y tecnologías requieren cierto grado de apoyo y respaldo clínico, que incluye el diagnóstico, la prescripción y dispensación y un seguimiento adecuado.
Para más información sobre el estado de la técnica, consulte la nota 67 del capítulo II. volver al texto
Asamblea Mundial de la Salud, resolución WHA60.29: Tecnologías sanitarias.volver al texto
Basado en la definición adoptada por el Grupo de Trabajo Mundial de Armonización del Instrumental Médico (GHTF). Véanse: GHTF (2005) y el apartado 6 de la sección A del presente capítulo.volver al texto