¿Por qué se realizó este estudio?
La salud pública es, por su naturaleza, un imperativo mundial y, por lo tanto, supone otorgar una prioridad alta a la cooperación internacional. La Organización Mundial de la Salud es la autoridad rectora y coordinadora en materia de salud, pero la interacción entre los problemas de salud y otras esferas -los derechos humanos, las políticas de desarrollo, la propiedad intelectual y el comercio internacional- constituye una sólida justificación de la necesidad de cooperación y coordinación entre la OMS y otras organizaciones internacionales, como la Organización Mundial de la Propiedad Intelectual y la Organización Mundial del Comercio. El presente estudio surge de un programa de cooperación trilateral que ejecutan estos organismos y responde a una demanda creciente, particularmente en los países en desarrollo, de fortalecimiento de la capacidad para formular políticas debidamente documentadas en los ámbitos de confluencia entre la salud, el comercio y la propiedad intelectual, centradas en el acceso a los medicamentos y a otras tecnologías médicas y en la innovación en esos ámbitos. La necesidad de cooperación y coherencia en el plano internacional se ha intensificado en el último decenio, como han confirmado sucesivas decisiones multilaterales (véase el recuadro).
El estudio se enmarca en un contexto de evolución de las políticas de salud: mientras que hace 10 años la atención se centraba en el acceso a los medicamentos para epidemias de enfermedades infecciosas, el debate se ha ampliado actualmente para abarcar las políticas relativas a la innovación y una gama más amplia de enfermedades y tecnologías médicas. Es cada vez más necesario que los responsables de la formulación de políticas comprendan la compleja interacción entre disciplinas diferentes, en un momento en el que la disponibilidad de mejores datos e instrumentos analíticos abre nuevas posibilidades en este ámbito. Un enfoque integrado puede reforzar una interacción dinámica y positiva entre las medidas que fomentan la innovación y las que favorecen el acceso a tecnologías médicas esenciales. Si bien en el estudio se aborda la cuestión más amplia de la innovación de todo tipo de tecnologías médicas y el acceso a ellas, se centra principalmente en el ámbito de los medicamentos, en el que se dispone de más experiencia práctica e información.
Hitos en el aumento de la coherencia |
|
2000 |
Observación general de las Naciones Unidas sobre el derecho a la salud |
2001 |
Declaración de Doha de la OMC relativa al Acuerdo sobre los ADPIC y la salud pública |
2002 |
Estudio conjunto de la OMS y la OMC titulado Los Acuerdos de la OMC y la salud pública |
2003/5 |
La OMC introduce en el Acuerdo sobre los ADPIC una nueva flexibilidad sobre el acceso a los medicamentos en los países que carecen de capacidad de fabricación |
2006 |
Informe de la Comisión de Derechos de Propiedad Intelectual, Innovación y Salud Pública de la OMS sobre salud pública, innovación y derechos de propiedad intelectual |
2007 |
Agenda de la OMPI para el Desarrollo |
2008 |
Estrategia mundial y plan de acción de la OMS sobre salud pública, innovación y propiedad intelectual |
2009 |
Comienzo de la cooperación trilateral entre la OMS, la OMPI y la OMC |
Estructura del estudio
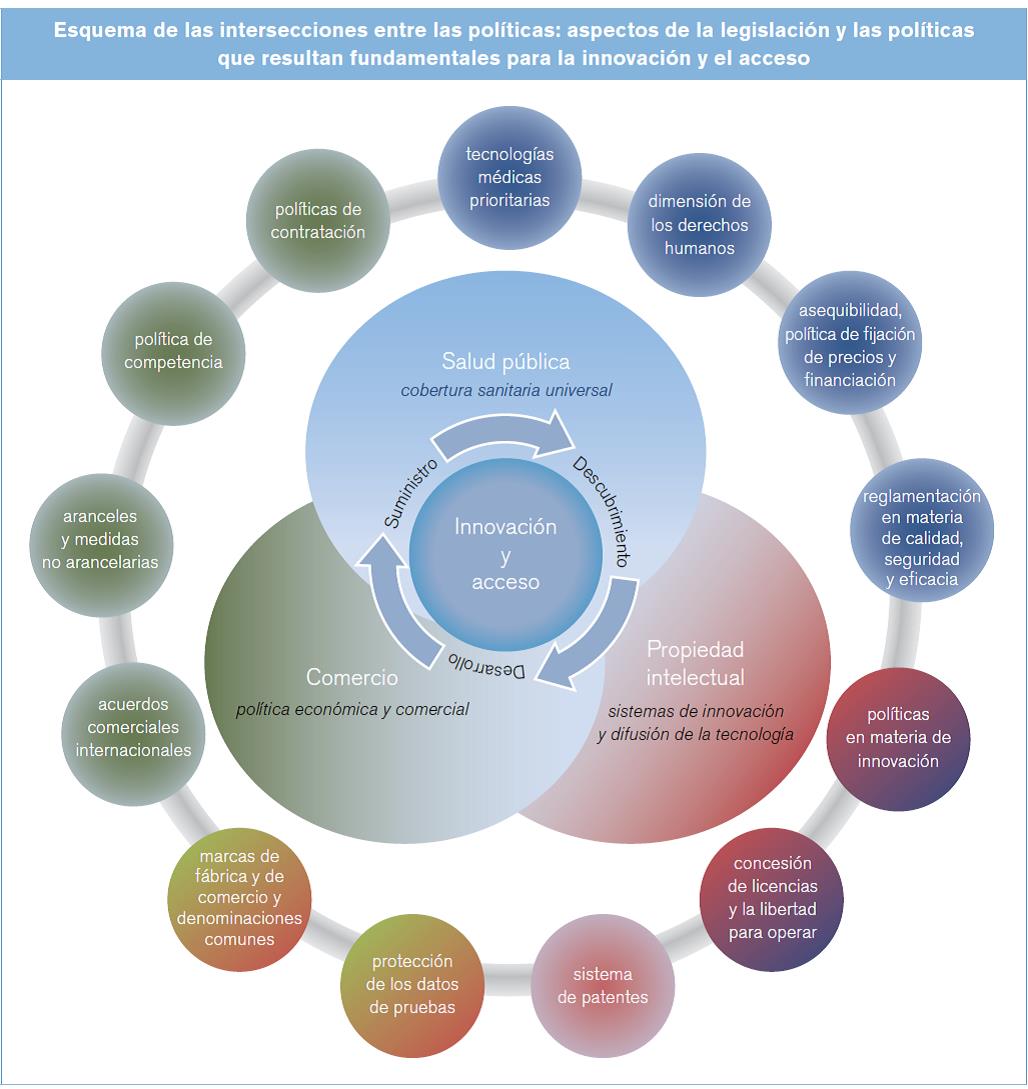
El estudio se ha concebido como un recurso orientado a fortalecer la capacidad de los responsables de la formulación de políticas; su estructura permite a los interesados comprender los fundamentos de las políticas y después analizar de forma más profunda ciertos aspectos de especial interés. Por lo tanto, se expone una visión general de las políticas (véase el capítulo II) que permite examinar todos los elementos interrelacionados en su contexto. A continuación, se proporcionan descripciones más detalladas de cuestiones relacionadas específicamente con la innovación (véase el capítulo III) y el acceso (véase el capítulo IV). En el documento se refleja la evolución del debate multilateral sobre políticas que ha tenido lugar en el último decenio: se reconoce que la innovación y el acceso están inevitablemente entrelazados, dado que sin innovación el acceso conllevaría una disminución de la capacidad para hacer frente a los cambios en la carga mundial de morbilidad y los innovadores deben estudiar el modo de poner las nuevas tecnologías al alcance de los más necesitados.
- En el capítulo I se ofrece una perspectiva general sobre las políticas de salud relativas a las tecnologías médicas, se definen las distintas funciones y mandatos de las tres organizaciones cooperantes, y se describe la carga mundial de morbilidad que define el reto fundamental en materia de políticas de salud. En vista de la importante contribución de diversos agentes a estas políticas, en el anexo I se describe una selección de entidades que participan en los procesos en curso pertinentes.
- En el capítulo II se describen los componentes fundamentales del marco internacional -las políticas de salud, la propiedad intelectual y las políticas comerciales-, y se sienta una base integrada para el análisis más detallado de las dimensiones relativas a la innovación y el acceso expuesto en las páginas siguientes. Se exponen las ideas clave de la economía con respecto a la innovación de las tecnologías médicas y el acceso a ellas, en vista de la utilización cada vez mayor de conceptos económicos en los debates sobre políticas de salud. En la última sección se examinan las cuestiones normativas relacionadas con los conocimientos médicos tradicionales, dada su importancia para los sistemas nacionales de salud y como aportación a la investigación médica.
- En el capítulo III se ofrece una descripción más pormenorizada de las cuestiones de política relativas a la innovación en el ámbito de las tecnologías médicas. La evolución histórica de la investigación y el desarrollo en medicina sirve como referencia para analizar las tendencias actuales en ese ámbito. En este capítulo se analiza el reto que suponen, a efectos de la innovación, las enfermedades desatendidas, así como los instrumentos alternativos y complementarios conexos para impulsar la investigación y el desarrollo. Se describe la función de los derechos de propiedad intelectual en el ciclo de la innovación y, en la sección final, se examinan las vacunas antigripales como ejemplo específico de la gestión de la innovación y el desarrollo de productos para hacer frente a una necesidad específica de salud de alcance mundial.
- En el capítulo IV se abordan los aspectos clave de la dimensión del acceso; se describe el contexto relativo al acceso a las tecnologías médicas y el marco actual para el acceso a los medicamentos esenciales. A continuación, se exponen los principales factores determinantes del acceso relacionados con los sistemas de salud, la propiedad intelectual y el comercio. En particular, se examinan las políticas de fijación de precios, los impuestos y los márgenes comerciales, y los mecanismos de adquisición, así como aspectos de la reglamentación e iniciativas de transferencia de tecnología y de impulso a la producción local, la calidad y los procedimientos de examen de las patentes, las licencias obligatorias y voluntarias, los acuerdos comerciales, los aranceles y las políticas de competencia.
Como los problemas relativos al acceso y la innovación se analizan cada vez más a menudo con una perspectiva más amplia, los debates sobre políticas involucran actualmente un conjunto más diverso de partes interesadas, valores, experiencias, conocimientos y datos empíricos mediante:
|
|
|
|
Dado el carácter transversal de estas esferas de políticas, algunos temas se presentan en el capítulo II, al describir el marco general de políticas, y se profundiza en ellos más adelante, en los capítulos III y IV, en los que se analiza con más detalle la relación de estos elementos con la innovación y el acceso, respectivamente. Por ejemplo, en el capítulo II se exponen los elementos y principios generales de las políticas de propiedad intelectual, mientras que en el capítulo III se detallan los aspectos de las políticas, las leyes y las prácticas del ámbito de la propiedad intelectual que guardan relación específica con la innovación de tecnologías médicas, y en el capítulo IV se examina la influencia de aspectos específicos de la propiedad intelectual en el acceso a estas tecnologías. Del mismo modo, en el capítulo II se describe, de forma general, el fundamento de la reglamentación de las tecnologías médicas, mientras que en los capítulos III y IV se tratan, respectivamente, las consecuencias de la reglamentación de los productos para el proceso de innovación y el acceso a las tecnologías médicas. En cuanto a las políticas comerciales, los elementos principales se exponen en el capítulo II, y en el capítulo IV se analiza el efecto del comercio y de las políticas comerciales en el acceso a los medicamentos y otras tecnologías médicas.
La carga mundial de morbilidad es un blanco móvil y se necesitan respuestas dinámicas …
Actualmente, la mayoría de los habitantes de los países de ingresos altos viven más de 70 años y mueren de enfermedades crónicas, que están también entre las principales causas de muerte en los países de ingresos medianos, junto con la tuberculosis, la infección por el VIH/sida y los accidentes de tránsito; sin embargo, en los países de bajos ingresos la mayoría de las personas mueren de enfermedades infecciosas y más de un tercio de los fallecidos son menores de 15 años. Para 2030 se prevén fuertes descensos en las tasas de mortalidad por las principales enfermedades transmisibles, maternas, perinatales y nutricionales. Pero el envejecimiento de las poblaciones en los países de bajos ingresos (PBI) y los de ingresos medianos (PIM) hará que aumente el número de muertes por enfermedades no transmisibles, lo que generará una doble carga de morbilidad. Son fundamentales las medidas preventivas con respecto a la forma de vida, la inactividad física, el consumo de tabaco y el consumo nocivo de bebidas alcohólicas, así como factores relativos a la alimentación y el medio ambiente; pero además el sistema de innovación deberá adaptarse a estos cambios en la carga mundial de morbilidad. En el pasado, el acceso a los medicamentos se centró en el ámbito de las enfermedades transmisibles, como la infección por el VIH/sida y el paludismo, pero actualmente se ha ampliado el enfoque. El acceso a los tratamientos de las enfermedades no transmisibles, en particular a los caros tratamientos contra el cáncer en los PIM, será el reto del futuro y el tema central del debate sobre el acceso (véase la sección C del capítulo I).
El acceso a los medicamentos y el derecho a la salud
El acceso a los servicios de salud y medicamentos esenciales es uno de los elementos necesarios para que todas las personas puedan ejercer el derecho a disfrutar del más alto nivel posible de salud. El fomento del acceso a los medicamentos también es parte de los Objetivos de Desarrollo del Milenio (véanse los apartados 1 a 3 de la sección A del capítulo II). En el marco de la OMS para el acceso a los medicamentos se reconoce que la falta de acceso a las tecnologías médicas rara vez se debe a un solo factor aislado; por lo tanto, incluye la selección y el uso racionales de los medicamentos, precios asequibles, financiación sostenible y unos sistemas de salud y de suministro fiables, con la calidad como elemento subyacente (véase la sección A.1 del capítulo IV). Para seleccionar de manera racional los medicamentos que necesita, cada país debe determinar qué productos son los más importantes para hacer frente a su carga de morbilidad específica. La selección puede basarse en las listas modelo de medicamentos esenciales de la OMS. Una condición básica para el acceso efectivo y sostenible es que exista compromiso político de proporcionar una financiación suficiente y sostenible (véase la sección A.1 del capítulo IV). Los precios asequibles son un determinante decisivo del acceso a los medicamentos, especialmente en los países con un sistema sanitario débil y en los que las personas con recursos escasos a menudo deben adquirir los medicamentos a precios de mercado. La competencia de los medicamentos genéricos es un factor clave para reducir los precios, pero en muchos PBI y PIM incluso los medicamentos genéricos de precios bajos son a menudo inasequibles para gran parte de la población y la disponibilidad de medicamentos esenciales en el sector público sigue siendo insuficiente (véase la sección A del capítulo IV). La condición general para proporcionar acceso a las tecnologías médicas y servicios de salud necesarios es la existencia de un sistema nacional de salud operativo (véanse la sección A.5 del capítulo II y la sección B del capítulo IV).
En los últimos años, los responsables de la formulación de políticas han prestado gran atención al acceso a los tratamientos para la infección por el VIH/sida. Los bajos precios de los tratamientos antirretrovíricos genéricos han ayudado a los gobiernos y a los programas de los donantes a avanzar hacia la consecución del objetivo de dar tratamiento a 15 millones de personas para 2015 (véase la sección A.2 del capítulo IV). Otros aspectos cruciales son la innovación de formulaciones y dispositivos médicos para uso pediátrico y el acceso a ellos (véanse los apartados 2 y 3 de la sección A del capítulo IV). La evolución de la carga de morbilidad también conduce a que se preste una mayor atención a cuestiones relativas al acceso y la propiedad intelectual en relación con las enfermedades no transmisibles (véase la sección A.2 del capítulo IV). Los programas nacionales de vacunación son un instrumento de salud pública muy eficaz para evitar enfermedades infecciosas y prevenir su propagación. Las condiciones particulares de cada mercado y las diferentes necesidades de conocimientos técnicos generan entornos diferentes para el desarrollo y la difusión de las vacunas (véanse la sección B.4 del capítulo III y la sección A.2 del capítulo IV, así como la sección E del capítulo III).
Los gobiernos exploran nuevas medidas para limitar los costos y aumentar el acceso
Los gobiernos aplican numerosas medidas diferentes para reducir los precios de las tecnologías médicas, entre las que cabe señalar los controles directos de los precios, el establecimiento de precios de referencia y la fijación de cuantías máximas de reembolso; además, cada vez utilizan más la evaluación de las tecnologías sanitarias para controlar los costos (véase la sección B.1 del capítulo IV). Además de los aranceles de importación (véase la sección D del capítulo IV), diversos impuestos (véase la sección B.3 del capítulo IV) y los márgenes comerciales aplicados a lo largo de la cadena de suministro (véase la sección B.4 del capítulo IV) también aumentan los precios que paga el consumidor y limitan el acceso. La eliminación de aranceles e impuestos y la regulación de los márgenes comerciales de distribución aplicados a lo largo de la cadena de suministro pueden reducir los precios, siempre y cuando se transfieran al consumidor. Sin embargo, la regulación de los precios también debe garantizar márgenes sostenibles para los proveedores comerciales.
Una herramienta complementaria para aumentar el acceso puede ser la fijación por las empresas de precios diferenciales, vinculando los precios al poder adquisitivo en función de los diferentes niveles de ingresos en mercados distintos (véase la sección B.2 del capítulo IV). Otra estrategia para mejorar el acceso a los medicamentos se centra en el desarrollo de la capacidad de producción local y el impulso a la transferencia de tecnología, lo que plantea cuestiones relativas al acceso a los medicamentos, los factores económicos y comerciales y las políticas industriales (véase la sección B.6 del capítulo IV).
En cuanto al acceso a los productos patentados, los países también hacen uso de las flexibilidades previstas en el Acuerdo sobre los ADPIC.
La reglamentación de las tecnologías es esencial en sí misma, pero puede afectar a la innovación y el acceso
La reglamentación de las tecnologías médicas responde a los siguientes objetivos esenciales en materia de políticas de salud: los productos deben ser inocuos, eficaces y de calidad aceptable. Además, conforma el entorno en que ocurren el acceso y la innovación; por ejemplo, unas normas de seguridad más estrictas obligan a generar más datos y, por consiguiente, aumentan el costo de la innovación. Los obstáculos normativos injustificados y los procesos prolongados de autorización de la comercialización retrasan el acceso a tecnologías médicas necesarias (véase la sección A.6 del capítulo II). La mayoría de los ensayos clínicos los realizan las empresas que desarrollan los productos objeto de los ensayos u otras empresas en su nombre. El registro de estos ensayos es una responsabilidad científica y ética, y por ello la OMS administra la Plataforma de registros internacionales de ensayos clínicos (ICTRP). Desde la perspectiva de las políticas de salud pública, los resultados de los ensayos clínicos deberían hacerse públicos para que los investigadores y otras partes interesadas puedan evaluar por sí mismos la eficacia y los posibles efectos secundarios de los nuevos productos (véase la sección B.5 del capítulo III). La aparición de los medicamentos biológicos ha planteado dificultades a los sistemas de reglamentación, en particular para reglamentar los productos derivados "biosimilares" (consulte la sección B.6 del capítulo II) y proporcionar, al mismo tiempo, suficientes incentivos a las empresas que elaboran el producto original.
Otro escollo para los sistemas de reglamentación es el aumento constante del número de productos médicos de calidad subestándar, espurios, de etiquetado engañoso, falsificados o de imitación que están planteando problemas de salud pública graves a escala mundial, y sobre todo en las regiones que cuentan con sistemas débiles de reglamentación y observancia. Para luchar eficazmente contra dichos productos debe aplicarse una combinación de medidas. Con el fin de eliminar los productos de calidad subestándar ha de exigirse la observancia de las normas sobre buenas prácticas de fabricación, mientras que para luchar contra los productos espurios, de etiquetado engañoso, falsificados o de imitación se necesitan otras medidas, por ejemplo, controles fronterizos y disposiciones del derecho penal, así como la colaboración entre los órganos legislativos, las fuerzas del orden público y los tribunales en los ámbitos nacional e internacional (véanse la sección B.1 del capítulo II y la sección B.7 del capítulo IV).
En general, los responsables de la reglamentación deben sopesar los beneficios derivados de una comercialización temprana de los productos nuevos y los problemas relativos a su seguridad, así como determinar un nivel de riesgo aceptable. La necesidad de simplificar la reglamentación, manteniendo al mismo tiempo su rigor y eficacia en función del costo, requiere más coordinación a través de los mecanismos de reglamentación regionales e internacionales, de modo que los proveedores puedan abastecer los mercados regionales sin enfrentarse a una reglamentación demasiado compleja o a unos costos excesivos (véase la sección A.6 del capítulo II). La armonización internacional plena de las normas de reglamentación sigue siendo un objetivo difícil de alcanzar. El Programa de la OMS de Precalificación de Medicamentos ha facilitado en gran medida el acceso de los países en desarrollo a productos médicos de calidad (véase la sección B.7 del capítulo IV).
La innovación de tecnologías médicas tiene lugar en un marco normativo complejo, en rápida evolución …
La innovación de tecnologías médicas requiere una compleja combinación de aportaciones de los sectores privado y público y se diferencia de la innovación general por la dimensión ética de la investigación médica, un marco de reglamentación riguroso, las consideraciones en materia de responsabilidad civil, los costos elevados y el alto riesgo de fracasos. El panorama actual de la investigación y el desarrollo ha sufrido una rápida transformación (debida a factores económicos, comerciales, tecnológicos y reglamentarios) y hoy incluye modelos de innovación más diversos y una gama más amplia de participantes. Históricamente, la función del sistema de patentes, en particular en el sector de los productos farmacéuticos, ha sido proporcionar incentivos enderezados a absorber los altos costos y los riesgos y responsabilidades conexos, una de las principales dificultades en materia de políticas. Las estimaciones del costo efectivo de la investigación y el desarrollo de productos médicos varían, pero la innovación es, sin duda, costosa y tarda mucho. El riesgo y la incertidumbre de la innovación aumentan los costos de la investigación y el desarrollo en este sector, pues hay que añadir el costo de los productos que no logran superar los requisitos reglamentarios para llegar a ser comercializados (véase la sección B.3 del capítulo III). El aumento de los gastos en investigación médica no ha ido acompañado de un aumento proporcional del número de productos nuevos introducidos en el mercado, lo que ha desencadenado un debate sobre la productividad de la investigación y una búsqueda de nuevos modelos de innovación y de financiación de la investigación y el desarrollo. Numerosas iniciativas están explorando nuevas estrategias para el desarrollo de productos, lo que ha dado pie a un intenso debate sobre la manera de mejorar y diversificar las estructuras de innovación para hacer frente a las necesidades aún no satisfechas en el ámbito de la salud. En los debates sobre políticas recientes se han examinado las posibilidades de los sistemas de innovación abiertos, así como una serie de incentivos y desincentivos, como los sistemas de fondos para premios que desvincularían el precio de los productos del costo de la investigación y el desarrollo (véase la sección C.2 del capítulo III).
… lo que ha impulsado una nueva perspectiva sobre la función y la estructura del sector, y acerca de la división entre lo público y lo privado
Esta transformación del panorama de la innovación está impulsando cambios en la industria farmacéutica, desencadenados por factores como unos presupuestos más limitados para la salud pública; la participación de entidades sin ánimo de lucro en la investigación y el desarrollo de productos médicos; la exposición a una reglamentación más estricta de los productos y mayores riesgos en materia de responsabilidad civil; las nuevas tecnologías que permiten tratamientos mejor dirigidos, y el crecimiento de la proporción de la demanda mundial que procede de los mercados emergentes. El modelo histórico del sector consistente en una investigación y un desarrollo integrados verticalmente en la empresa y la comercialización en exclusiva está dando paso a sistemas más diversos y colaborativos en los que grandes empresas del sector desarrollan productos que integran tecnologías obtenidas de terceros, ya sea comprando las licencias o mediante la fusión e integración de empresas más pequeñas. Las empresas de investigación también han invertido en la capacidad de producción de genéricos. También se ha analizado el papel de las universidades y centros de investigación públicos, cada vez mayor en los países en desarrollo, que aspiran a conciliar sus responsabilidades de cara al interés público con la necesidad de establecer asociaciones con el sector privado para ofrecer nuevos productos médicos (véanse las secciones A y B del capítulo III y la sección C del capítulo II).
Las enfermedades desatendidas: un problema en materia de políticas, pero también un asunto de interés creciente para las iniciativas prácticas
En los modelos de innovación basados en el mercado no se tiene en cuenta la carga de morbilidad específica de los países en desarrollo: las llamadas enfermedades desatendidas. Desde que se detectó este déficit de la investigación en el sector de la salud, el panorama de la investigación sobre estas enfermedades ha evolucionado. Una importante novedad en el último decenio ha sido la creación de asociaciones para el desarrollo de productos, que reúnen a entidades sin fines de lucro y a agentes del sector industrial, que reciben importantes fondos filantrópicos; esto ha generado un aumento considerable del número de productos en desarrollo para enfermedades desatendidas y ha señalado vías para colmar las lagunas de investigación existentes (véase la sección C.4 del capítulo III). Además, cada vez más empresas de investigación farmacéutica emprenden actividades de investigación filantrópicas. Varias empresas han creado centros dedicados exclusivamente a la investigación de las enfermedades que afectan de manera desproporcionada a los países en desarrollo o han participado en proyectos de cooperación para compartir activos y conocimientos; es el caso del consorcio WIPO Re:Search, una iniciativa de la OMPI desplegada para hacer un mejor uso de los activos protegidos por la propiedad intelectual y mejorar el acceso (véanse los apartados 5 y 6 de la sección C del capítulo III). No obstante, la comunidad internacional aún tiene mucho por hacer en este ámbito. El Grupo consultivo de expertos de la OMS en investigación y desarrollo: financiación y coordinación ha recomendado que comience a negociarse un tratado jurídicamente vinculante a nivel mundial sobre la investigación y el desarrollo orientados a las enfermedades desatendidas. Los Estados miembros de la OMS debatieron las recomendaciones del Grupo en una reunión intergubernamental que se celebró en noviembre de 2012 (véase la sección C.3 del capítulo III).
El régimen de propiedad intelectual ocupa un lugar central en el debate sobre la innovación y el acceso …
Son varios los elementos del sistema de propiedad intelectual que guardan relación con la innovación y el acceso (véase la sección B.1 del capítulo II). La atención se ha centrado en el sistema de patentes y en la protección de los datos de las pruebas, pero hay otros aspectos de la propiedad intelectual de interés, como la relación entre las marcas de fábrica o de comercio y las denominaciones comunes internacionales (DCI) de la OMS, y cuestiones relativas a los derechos de autor del prospecto de envase de los medicamentos (véase la sección B.1 del capítulo II). El sistema de patentes ha sido utilizado ampliamente en el ámbito de las tecnologías médicas, especialmente por el sector farmacéutico. De hecho, el sector farmacéutico destaca por su dependencia de las patentes para obtener beneficios de la inversión en investigación y desarrollo, pero continúa debatiéndose su función en la innovación y la manera de mejorar su eficacia (véase la sección B del capítulo III). Las patentes, en principio, promueven la innovación proporcionando incentivos para invertir en investigación y desarrollo, una consideración de interés particular para el sector privado. Las patentes permiten estructurar, definir y hacer crecer las asociaciones cuya finalidad es la innovación. El efecto de las patentes sobre el acceso es complejo y un ámbito al que se presta especial atención: dadas las diferentes opciones de políticas, la mera existencia de una patente no tiene por qué constituir una barrera absoluta para el acceso pero, de igual modo, la ausencia del derecho que confiere una patente no ofrece garantía alguna en lo que respecta al acceso efectivo (véase la sección C del capítulo IV).
En el Acuerdo sobre los ADPIC se establecen normas mínimas relativas a la protección y la observancia de la propiedad intelectual. Por ejemplo, se deben poder patentar todas las innovaciones en todos los campos de la tecnología, siempre que sean nuevas, impliquen actividad inventiva (no sean evidentes) y sean susceptibles de aplicación industrial (o sean útiles). En la sección D del capítulo III se describe la función de los derechos de propiedad intelectual en el ciclo de la innovación. Los criterios de patentabilidad rigurosos y el examen estricto de las patentes con el apoyo de directrices para tal efecto contribuyen a evitar estrategias empleadas para retrasar la introducción de medicamentos genéricos, como la "perpetuación" (evergreening) o renovación permanente de la validez de sus patentes (véanse la sección D.3 del capítulo III y la sección C.1 del capítulo IV). Un componente integral del sistema de patentes es la obligación de facilitar el acceso a la innovación patentada mediante su divulgación pública, creando así una amplia base de conocimientos. La información sobre la patente divulgada sirve como instrumento para determinar la libertad de acción, las posibles asociaciones de carácter tecnológico y las opciones de adquisición, y ofrece a los responsables de la formulación de políticas información acerca de las pautas de la innovación (véase la sección B.5 del capítulo IV). La información de las patentes es, por lo general, más accesible pero sigue siendo difícil obtener datos relativos a muchos países en desarrollo. Recientemente se ha observado un aumento de las solicitudes de patentes sobre tecnologías médicas de una gama más diversa de entidades públicas y privadas, y de las principales economías emergentes (véase la sección B.1 del capítulo II).
La protección de los datos de los ensayos clínicos también ilustra la compleja relación entre el régimen de propiedad intelectual y la innovación y el acceso. Es importante proteger estos datos contra el uso comercial desleal, dados los considerables esfuerzos realizados para generar estos datos e introducir así nuevos medicamentos en el mercado. Por el contrario, ciertos tipos de protección de los datos de las pruebas pueden retrasar la entrada de los medicamentos genéricos. En el Acuerdo sobre los ADPIC se exige la protección de los datos de pruebas, pero no se especifica cómo debe hacerse, y las autoridades de cada país han adoptado criterios diversos (véase la sección B.1 del capítulo II).
El tipo de licencia de las patentes puede determinar su repercusión en la salud pública …
Un sistema adecuado de concesión de licencias de patentes puede ayudar a forjar alianzas y facilitar la innovación a través de la cooperación para generar nuevas tecnologías médicas. Las estrategias de concesión de licencias del sector privado normalmente tienen objetivos comerciales, pero las entidades del sector público pueden utilizar las patentes expresamente para lograr resultados en la esfera de la salud pública. Los nuevos modelos de concesión de licencias socialmente responsables protegen la propiedad intelectual y al mismo tiempo favorecen que las comunidades desatendidas tengan acceso a las nuevas tecnologías médicas en condiciones asequibles. Por medio de las asociaciones público-privadas se han alcanzado acuerdos creativos de concesión de licencias en los que se renuncia a maximizar el beneficio para proporcionar a cambio tecnologías esenciales para los países más pobres a precios asequibles. En los programas de responsabilidad social de las empresas se incluye también la concesión de licencias voluntarias, especialmente para los tratamientos de la infección por el VIH/sida. El consorcio Medicines Patent Pool (Fondo de patentes de medicamentos) ha reforzado la tendencia a establecer programas de concesión de licencias voluntarias, que aumentan el acceso a los medicamentos al permitir nuevas formulaciones y mejorar el suministro de medicamentos genéricos más baratos para los países en desarrollo (véase la sección C.2 del capítulo IV).
… al igual que las opciones en materia de políticas y las flexibilidades del sistema de propiedad intelectual
El régimen internacional de la propiedad intelectual comprende una amplia gama de flexibilidades y opciones para la formulación de políticas que se pueden utilizar para perseguir objetivos de salud pública. Sin embargo, estas opciones no se aplican de forma automática a escala internacional, y en los países es necesario estudiar el mejor modo de aplicar este tipo de flexibilidades de forma óptima, para que el régimen nacional de la propiedad intelectual responda a las necesidades y objetivos en materia de políticas particulares de cada país. Entre las principales opciones figuran los períodos de transición para los países menos adelantados (véase la sección B.1 del capítulo II), diferentes regímenes de agotamiento de los derechos de propiedad intelectual, el perfeccionamiento de los criterios para la concesión de una patente, los procedimientos de oposición anterior y posterior a la concesión, y las excepciones y limitaciones a los derechos de patente una vez conferidos, en particular la excepción del examen reglamentario (excepción Bolar) para facilitar la entrada en el mercado de medicamentos genéricos, las licencias obligatorias y la utilización por los gobiernos. Los países han utilizado estos instrumentos para mejorar el acceso a los medicamentos tanto para las enfermedades transmisibles como para las no transmisibles (véanse los apartados 1 a 3 de la sección C del capítulo IV). Los Miembros de la OMC han acordado modificar el Acuerdo sobre los ADPIC para permitir un uso más amplio de las licencias obligatorias para el acceso a los medicamentos, eliminando una posible barrera jurídica para los países que necesitan importar medicamentos producidos en el extranjero al amparo de una licencia obligatoria, a través de la concesión de licencias obligatorias especiales para la exportación en virtud del denominado "sistema del párrafo 6" (véanse la sección C.2 del capítulo IV y el anexo II). Si bien ahora, gracias también a la Declaración de Doha sobre la salud pública, está más claro el alcance jurídico de las flexibilidades y algunas se aplican con frecuencia (como las excepciones Bolar), los responsables de la formulación de políticas continúan debatiendo acerca del uso de medidas como las licencias obligatorias.
El comercio internacional es una vía indispensable para el acceso, pero no elimina las diferencias económicas
El comercio internacional es vital para el acceso a los medicamentos y otras tecnologías médicas, especialmente en los países más pequeños y con menos recursos. El comercio estimula la competencia, que a su vez reduce los precios y amplía la gama de proveedores, lo que mejora la seguridad y la previsibilidad del suministro. Por lo tanto, las políticas comerciales, como los aranceles sobre los medicamentos, los ingredientes farmacéuticos y las tecnologías médicas, afectan directamente a su accesibilidad (véanse los apartados 3 al 5 de la sección B del capítulo II y la sección D del capítulo IV). Las políticas comerciales y la economía de los sistemas de producción mundiales son también factores clave en los planes estratégicos de los países para fortalecer su capacidad de producción interior de productos médicos. Para contar con un suministro estable de productos sanitarios de calidad también es importante que los países cuenten con reglamentos no discriminatorios basados en principios sólidos en materia de políticas de salud. El acceso a las oportunidades que genera el comercio exterior puede crear economías de escala que permitan compensar los costos e incertidumbres de la investigación médica y los procesos de desarrollo de productos.
Los países desarrollados han dominado el comercio de productos relacionados con la salud, pero la India y China se han convertido en los principales exportadores mundiales de insumos farmacéuticos y químicos, y en otros países en desarrollo las exportaciones también han experimentado un fuerte crecimiento. Las importaciones de productos relacionados con la salud difieren drásticamente de unos países a otros en función de su nivel de desarrollo, lo que pone de manifiesto la existencia de brechas sustanciales -y cada vez mayores- en el acceso: en los últimos años, las importaciones de los países menos adelantados, que ya tenían un nivel bajo, son las que menos han crecido.
Los aranceles a la importación de productos relacionados con la salud pueden afectar al acceso: el aumento del costo que generan en el comienzo de la cadena de valor puede multiplicar su impacto en los precios. Los países desarrollados han eliminado la mayor parte de estos aranceles, de conformidad con un acuerdo de la OMC sobre el comercio de productos farmacéuticos. Otros países los han reducido considerablemente, pero sigue habiendo un panorama heterogéneo: algunos países en desarrollo diseñan sus regímenes arancelarios para fomentar la producción local, mientras que los países menos adelantados aplican aranceles más bajos (véase la sección D.1 del capítulo IV).
Las políticas de competencia promueven una innovación eficaz y ayudan a determinar las condiciones de acceso
Las políticas de competencia afectan a todas las etapas del proceso de suministro de tecnología médica a los pacientes, desde la etapa de desarrollo hasta las de la venta y la aplicación. La creación de estructuras de mercado sólidas y que fomentan la competencia mediante la promulgación y aplicación de leyes sobre el particular desempeña, por lo tanto, una función importante tanto en la mejora del acceso a la tecnología médica como en el fomento de la innovación en el sector farmacéutico. Si los derechos de propiedad intelectual obstaculizan la competencia y, por lo tanto, constituyen un posible obstáculo para la innovación y el acceso, esas estructuras pueden servir como mecanismo corrector. Las autoridades responsables de la competencia de varias jurisdicciones han tomado medidas para hacer frente a las prácticas contrarias a la competencia en el sector farmacéutico, en particular algunos acuerdos sobre patentes y ciertas prácticas de concesión de licencias y políticas de fijación de precios. Las políticas de competencia también desempeñan una función importante en la prevención de la colusión entre los proveedores de tecnología médica que participan en los procesos de contratación (véanse la sección C.2 del capítulo II y la sección D.2 del capítulo IV).
El acceso a las tecnologías médicas a través de una contratación pública más eficaz
En muchos países, el acceso a las tecnologías médicas se realiza, en gran parte, mediante contratación pública y los productos farmacéuticos se costean con fondos públicos o subvenciones. La finalidad de los sistemas de adquisición es obtener medicamentos y otros productos médicos de buena calidad, en el momento adecuado, en las cantidades requeridas y a un costo favorable. Estos principios son especialmente importantes en el sector de la salud dado el gran nivel de gastos, el impacto en la salud de la relación calidad-precio y las consideraciones relativas a la calidad; según consta, en algunos programas se paga por los medicamentos mucho más de lo necesario (véase la sección B.5 del capítulo IV). Las políticas de adquisición que favorecen la licitación abierta y competitiva son cada vez más importantes en un contexto fiscal en el que los presupuestos nacionales están sujetos a presión y los programas filantrópicos restringen la financiación. La buena gobernanza en la contratación se asocia con el aumento del acceso a las tecnologías médicas, ya que permite que los precios sean más bajos y el suministro no se interrumpa. El Acuerdo sobre Contratación Pública de la OMC es un mecanismo plurilateral que ofrece un marco normativo internacional para promover la eficiencia y la buena gobernanza en la contratación pública, en particular para la adquisición de medicamentos, la promoción de la transparencia, la competencia leal y la mejora de la relación calidad-precio en el gasto público (véase la sección B.4 del capítulo II).
Cada vez es mayor la repercusión en el acceso de los acuerdos de libre comercio alcanzados al margen de la esfera multilateral
El marco internacional de formulación de políticas y jurídico se ha hecho más complejo debido al número cada vez mayor de acuerdos comerciales y de propiedad intelectual alcanzados recientemente al margen de los foros multilaterales establecidos. El debate sobre políticas se ha centrado en las medidas relativas a la propiedad intelectual y la reglamentación farmacéutica que figuran en estos acuerdos, y en su repercusión sobre el acceso a los medicamentos. Por ejemplo, las medidas de prórroga de la vigencia de las patentes o de exclusividad de los datos, y otras medidas como la vinculación de patentes que figuran en algunos acuerdos de libre comercio están concebidas para incentivar la innovación, pero también pueden repercutir en el acceso a los medicamentos al retrasar la entrada de los productos genéricos en el mercado (véase la sección C.5 del capítulo IV). En estos acuerdos también se establecen normas en otros ámbitos de políticas que inciden en el acceso, en particular las normas establecidas en materia de contratación pública y las políticas de competencia, así como los aranceles preferenciales para los productos farmacéuticos, los insumos y otros productos sanitarios (véanse la sección B.5 del capítulo II y la sección C.5 del capítulo IV). Aún no se ha analizado de modo sistemático el efecto general de esta tendencia en el sistema internacional, en particular la repercusión total de todos estos acuerdos en el acceso a las tecnologías médicas.